Trabalhamos com diferentes tipos de células, baterias e soluções de sistemas de armazenamento de energia.
Para dúvidas sobre nossos produtos, deixe um comentário e entraremos em contato em até 24 horas.

Trabalhamos com diferentes tipos de células, baterias e soluções de sistemas de armazenamento de energia.
Para dúvidas sobre nossos produtos, deixe um comentário e entraremos em contato em até 24 horas.
Se você já se perguntou por que as baterias de íon-lítio são usadas em smartphones e veículos elétricos, a resposta está em sua incrível densidade de energia.
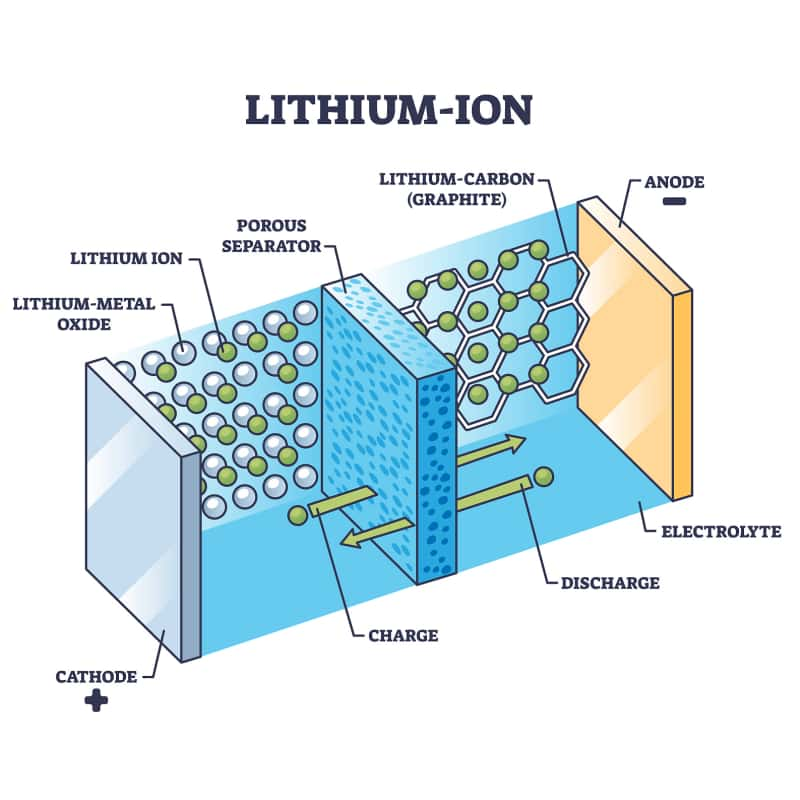
Imagine uma bateria como um sistema com dois tanques separados de "partículas de energia" (íons de lítio).CarregandoForça as partículas de um tanque para o outro, armazenando energia.Descarregandopermite que eles fluam de volta, liberando essa energia para alimentar seu dispositivo.
Ânodo (eletrodo negativo):Geralmente feito degrafite(carbono). Este é o "tanque" onde os íons de lítio são armazenados quando a bateria está carregada.
Cátodo (eletrodo positivo):Feito de óxido de lítio metálico (como óxido de lítio-cobalto ou fosfato de ferro-lítio). Este é o outro "tanque".
Qual é o papel do eletrólito em uma bateria de íon-lítio?:Um líquido ou gel que fica entre o ânodo e o cátodo. Ele permiteíons de lítiopara atravessá-lo, mas bloqueiaelétrons(Isto é fundamental!).
Separador:Uma membrana porosa dentro do eletrólito que impede o contato entre o ânodo e o cátodo (o que causaria um curto-circuito).
Circuito externo:O fio ou caminho que conecta o ânodo e o cátodo na parte externa da bateria. É aqui queelétronsfluxo para alimentar seu dispositivo.
Ao ligar o aparelho, você fecha o circuito e uma reação química começa espontaneamente.
Íons de lítio para viagens:Íons de lítio armazenados noânodo de grafitese desprender e nadar através doeletrólitopara ocátodo.
Elétrons percorrem a rota panorâmica:Para cada íon que se move, um elétron é liberado do ânodo. O eletrólito bloqueia os elétrons, forçando-os a assumir a posição correta.circuito externo(através dos componentes do seu telefone) para chegar ao cátodo. Esse fluxo de elétronsé eletricidade, alimentando seu dispositivo.
Reunião:No cátodo, os elétrons e os íons de lítio se recombinam e se incorporam ao material do cátodo.
Resumo da alta hospitalar:Ânodo (Grafite + Li)→Elétrons (dispositivo de energia) + Li⁺ (através do eletrólito)→Cátodo (recombinação de Li)
Energia é liberada.
Ao ligar o aparelho na tomada, uma força elétrica externa é aplicada, empurrando o sistema em sentido inverso.
Energia externa impulsiona elétrons:O carregador força o fluxo de elétrons.voltardo cátodo para o ânodo.
Íons de lítio a seguir:Isso extrai os íons de lítio do material do cátodo, forçando-os a nadar de volta através do eletrólito até o ânodo.
Armazenar:Os íons se reinserem na estrutura de grafite do ânodo, ficando prontos para o próximo ciclo de descarga.
Resumo da cobrança:Cátodo (Li)→Li⁺ (forçado através do eletrólito pelo carregador)→Ânodo (Grafite + Li)
A energia é armazenada.
Imagine uma roda d'água que aciona um moinho:
O Estado Carregado:Toda a água (íons de lítio) está nobalde superior (ânodo)Isso representa energia armazenada.
Descarregando:Você abre o portão. A água escorre do balde de cima, através doroda d'água (seu dispositivo), para dentro dobalde inferior (cátodo)A roda d'água giratória funciona.
Carregando:Você usa uma bomba (seu carregador) para forçar a água do balde inferior de volta para o balde superior, armazenando energia novamente.
Deixe um recado
Escaneie para o WeChat :

Hi! Click one of our members below to chat on